
Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Хвороба Гентінгтона
Медичний експерт статті
Останній перегляд: 05.07.2025
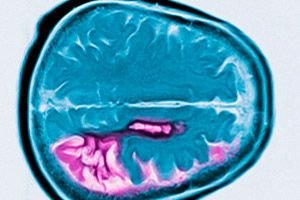
Хвороба Хантінгтона – це аутосомно-домінантне нейродегенеративне захворювання, що характеризується прогресуючим когнітивним зниженням, мимовільними рухами та порушенням рухової координації, що починається в середньому віці. Діагноз підтверджується генетичним тестуванням. Лікування переважно симптоматичне. Генетичне тестування може бути рекомендовано кровним родичам. Джордж Хантінгтон вперше описав цей стан у 1872 році після вивчення сімейного випадку у жителів Лонг-Айленда.
Поширеність хвороби Хантінгтона становить приблизно 10 випадків на 100 000 населення, і враховуючи її пізній початок, приблизно 30 людей зі 100 000 мають 50% ризик розвитку її протягом життя. Хоча захворювання найчастіше проявляється у віці від 35 до 40 років, віковий діапазон початку захворювання досить широкий, причому найраніший початок припадає на 3 роки, а найпізніший – на 90 років. Хоча спочатку вважалося, що захворювання має 100% пенетрантність, зараз вважається, що це не завжди так. У осіб, які успадкували ген захворювання від батька, захворювання проявляється в середньому на 3 роки раніше, ніж у тих, хто успадкував патологічний ген від матері. Приблизно у 80% пацієнтів, які успадкували патологічний ген від батька, захворювання проявляється до 20 років. Явище більш раннього прояву генетичного дефекту у потомства називається антиципацією.
 [ 1 ]
[ 1 ]
Що викликає хворобу Хантінгтона?
Хвороба Хантінгтона не має статевої переваги. Проявляється атрофією хвостатого ядра, де дегенерують дрібні нейрони та падає рівень нейромедіаторів – гамма-аміномасляної кислоти (ГАМК) та речовини Р.
Мутантний ген зі збільшеною кількістю («розширенням») послідовностей ДНК CAG (цистеїн-аланін-гліцин), що кодують амінокислоту глутамін, відповідає за розвиток хвороби Хантінгтона. Продукт цього гена, великий білок хантінгтин, містить надмірну кількість залишків поліглутаміну, що призводить до захворювання невідомим механізмом. Чим більше повторів CAG, тим раніше дебютує захворювання та тим важчий його перебіг. З покоління в покоління кількість повторів може збільшуватися, що з часом призводить до посилення сімейного фенотипу.
Незважаючи на значний інтерес до генетичних та біохімічних змін при хворобі Паркінсона, пошук гена, що відповідає за цю хворобу, був безуспішним до кінця 1970-х років. У той час Ненсі Векслер та Аллан Тобін організували семінар, спонсорований Фондом спадкових захворювань, для обговорення стратегії пошуку гена хвороби Хантінгтона. Девід Хаусман, Девід Ботштейн та Рей Вайт, які були присутні на зустрічі, припустили, що нещодавно розроблені методи рекомбінантної ДНК можуть допомогти досягти цієї мети. Ключовим завданням проекту було знайти велику родину з багатьма поколіннями хвороби Хантінгтона для отримання зразків ДНК. У 1979 році було розпочато спільний проект вчених з Венесуели та Сполучених Штатів для обстеження великої родини з хворобою Хантінгтона, яка проживає на берегах озера Маракеїбо (Венесуела). У 1983 році ген хвороби Хантінгтона був локалізований на кінці короткого плеча хромосоми 4 (Gusella et al., 1983), а десятиліття потому було виявлено, що мутація цього гена полягає у збільшенні кількості повторів тринуклеотиду цитозин-аденін-гуанін (CAG) (Huntington's Disease Collaborative Research Group, 1993). Методологія, розроблена цією науковою групою, наразі вважається стандартною для позиційного клонування нових генів.
У той час як ген дикого типу має розтягнення з 10-28 CAG-повторів, мутантна форма гена, що викликає хворобу Хантінгтона, має збільшене розтягнення від 39 до понад 100 CAG-повторів. Відкриття розширення тринуклеотидних повторів допомогло пояснити багато клінічних особливостей захворювання. Зокрема, було виявлено зворотну кореляцію між віком початку захворювання та довжиною ділянки з повторюваними тринуклеотидами. Передбачення батьківського успадкування можна пояснити тим, що збільшення кількості повторів часто відбувається у чоловіків під час сперматогенезу. Аналіз нових мутацій показав, що вони зазвичай виникають, коли один з батьків, зазвичай батько, мав кількість CAG-повторів вище 28; у цьому випадку кількість цих повторів збільшувалася в наступному поколінні. Зараз встановлено, що якщо кількість повторів не перевищує 28, вона стабільно передається з покоління в покоління. Якщо кількість повторів від 29 до 35, то симптоми хвороби Хантінгтона не проявляються, але при передачі потомству довжина цієї ділянки може збільшуватися. Якщо кількість повторів від 36 до 39, то в деяких випадках (але не завжди) захворювання може проявлятися клінічно (неповна пенетрантність), а при передачі потомству можливе збільшення кількості тринуклеотидних повторів. Якщо кількість повторів перевищує 40, то захворювання виникає майже у всіх випадках, а при передачі потомству можливе подальше розширення повторів. Причини збільшення кількості повторів залишаються невідомими.
Патоморфологія хвороби Хантінгтона
Хвороба Хантінгтона характеризується втратою нейронів переважно в хвостатому ядрі та путамені, а також певною мірою в корі та інших структурах мозку. Загальна маса мозку при хворобі Хантінгтона зменшується не лише за рахунок зменшення кількості нейронів, але й за рахунок втрати білої речовини. У корі головного мозку найбільше уражаються клітини в шарах V та VI. Тяжкість мікро- та макроскопічних дегенеративних змін (з урахуванням віку на момент смерті) корелює з кількістю CAG-повторів. Детальний патологічний аналіз змін у кількох сотнях випадків хвороби Хантінгтона показав, що дегенерація стріатуму починається в дорсомедіальній частині хвостатого ядра та дорсолатеральній частині путамену, а потім поширюється вентрально. Різні групи нейронів у хвостатому ядрі та путамені уражаються різною мірою. Інтернейрони в стріатумі залишаються відносно неушкодженими, але деякі проекційні нейрони уражаються вибірково. При ювенільній формі хвороби Хантінгтона патоморфологічні зміни в стріатумі більш виражені та поширені, залучаючи кору головного мозку, мозочок, таламус та бліду кулю.
Нейрохімічні зміни при хворобі Хантінгтона
ГАМК. Нейрохімічні дослідження мозку у пацієнтів з хворобою Хантінгтона виявили значне зниження концентрації ГАМК у стріатумі. Подальші дослідження підтвердили, що хвороба Хантінгтона пов'язана зі зменшенням кількості ГАМКергічних нейронів, і показали, що концентрації ГАМК знижені не тільки у стріатумі, але й у його проекційних зонах - зовнішньому та внутрішньому сегментах блідої кулі та чорній субстанції. У мозку при хворобі Хантінгтона зміни ГАМК-рецепторів також були виявлені за допомогою досліджень зв'язування рецепторів та гібридизації мРНК in situ. Кількість ГАМК-рецепторів була помірно знижена в хвостатому ядрі та путамені, але збільшена в ретикулярній частині чорної субстанції та зовнішньому сегменті блідої кулі, що, ймовірно, пов'язано з денерваційною гіперчутливістю.
Ацетилхолін. Ацетилхолін використовується як нейромедіатор великими нешипчастими інтернейронами стріатуму. Ранні посмертні дослідження у пацієнтів з хворобою Хантінгтона показали зниження активності холінацетилтрансферази (ХАТ) у стріатумі, що свідчить про втрату холінергічних нейронів. Однак, порівняно зі значним зниженням кількості ГАМКергічних нейронів, холінергічні інтернейрони відносно збережені. Таким чином, щільність ацетилхолінестераза-позитивних нейронів та активність ХАТ у стріатумі насправді відносно підвищені порівняно з контрольною групою відповідного віку.
Речовина Р. Речовина Р міститься в багатьох середніх колючих нейронах стріатуму, які переважно проектуються до внутрішнього сегмента блідої кулі та чорної субстанції і зазвичай також містять динорфін та ГАМК. Рівень речовини Р у стріатумі та сітчастій частині чорної субстанції знижений при хворобі Хантінгтона. На термінальній стадії захворювання імуногістохімічні дослідження виявили значне зменшення кількості нейронів, що містять субстанцію Р. На ранніх стадіях нейрони, що містять субстанцію Р та проектуються до внутрішнього сегмента блідої кулі, відносно збережені порівняно з нейронами, що проектуються до сітчастої частини чорної субстанції.
Опіоїдні пептиди. Енкефалін міститься в середніх шипастих ГАМКергічних нейронах непрямого шляху, які проектуються до зовнішнього сегмента блідої кулі та несуть D2-рецептори. Імуногістохімічні дослідження показали, що нейрони, що містять енкефалін та проектуються до зовнішнього сегмента блідої кулі, втрачаються на ранніх стадіях хвороби Хантінгтона. Ці клітини, очевидно, гинуть раніше, ніж клітини, що містять субстанцію Р та проектуються до внутрішнього сегмента блідої кулі.
Катехоламіни. Нейрони, що містять біогенні аміни (дофамін, серотонін) та проектуються до стріатуму, розташовані в компактній частині чорної субстанції, вентральному тегментумі та ядрах шва. Хоча норадренергічні проекції до людського стріатуму мінімальні, рівні серотоніну та дофаміну (на грам тканини) у стріатумі підвищені, що свідчить про збереження цих аферентних проекцій, незважаючи на помітну втрату власних нейронів стріатуму. Дофамінергічні нейрони чорної субстанції залишаються інтактними як при класичній, так і при ювенільній формах хвороби Хантінгтона.
Соматостатин/нейропептид Y та синтетаза оксиду азоту. Вимірювання рівнів соматостатину та нейропептиду Y у стріатумі при хворобі Хантінгтона виявило 4-5-кратне збільшення порівняно з нормальними тканинами. Імуногістохімічні дослідження показали абсолютне збереження стріатумних інтернейронів, що містять нейропептид Y, соматостатин та синтетазу оксиду азоту. Таким чином, ці нейрони стійкі до патологічного процесу.
Збудливі амінокислоти. Було висловлено припущення, що селективна загибель клітин при хворобі Хантінгтона зумовлена нейротоксичним ефектом, індукованим глутаматом. Рівні глутамату та хінолінової кислоти (ендогенного нейротоксину, що є побічним продуктом метаболізму серотоніну та агоністом рецепторів глутамату) у стріатумі при хворобі Хантінгтона дещо змінені, але нещодавнє дослідження з використанням МР-спектроскопії виявило підвищення рівня глутамату in vivo. Рівень гліального ферменту, відповідального за синтез хінолінової кислоти, у стріатумі при хворобі Хантінгтона підвищений приблизно в 5 разів порівняно з нормою, тоді як активність ферменту, що забезпечує деградацію хінолінової кислоти, підвищена при хворобі Хантінгтона лише на 20-50%. Таким чином, синтез хінолінової кислоти може бути підвищений при хворобі Хантінгтона.
Дослідження рецепторів збуджуючих амінокислот (ЕАА) при хворобі Хантінгтона виявили значне зменшення кількості NMDA-, AMPA-, каїнатних та метаботропних глутаматних рецепторів у стріатумі, а також AMPA- та каїнатних рецепторів у корі головного мозку. На пізній стадії хвороби Хантінгтона NMDA-рецептори практично були відсутні, тоді як на доклінічній та ранній стадіях відзначалося значне зменшення кількості цих рецепторів.
Вибіркова чутливість. При хворобі Хантінгтона певні типи стріарних клітин вибірково втрачаються. Середні шипасті нейрони, що проектуються до зовнішнього сегмента блідої кулі та містять ГАМК та енкефалін, гинуть дуже рано на початку захворювання, як і нейрони, що містять ГАМК та речовину Р і проектуються до ретикулярної частини чорної субстанції. Втрата нейронів, що містять ГАМК та енкефалін та проектуються до зовнішнього сегмента блідої кулі, розгальмує цю структуру, що, у свою чергу, призводить до активного гальмування субталамічного ядра. Зниження активності субталамічного ядра, очевидно, може пояснити хореїформні рухи, що виникають при хворобі Хантінгтона. Давно відомо, що вогнищеві ураження субталамічного ядра можуть викликати хорею. Втрата нейронів ГАМК та речовини Р, що проектуються до ретикулярної частини чорної субстанції, ймовірно, відповідає за окорухові порушення, що спостерігаються при хворобі Хантінгтона. Цей шлях зазвичай пригнічує нейрони ретикулярної частини чорної субстанції, що проектуються до верхнього бугра, які, у свою чергу, регулюють саккади. При ювенільній хворобі Хантінгтона вищезгадані шляхи уражаються сильніше, і, крім того, стріатумні проекції до внутрішнього сегмента блідого кулі втрачаються рано.
Білок хантингтин, що кодується геном, мутація якого викликає хворобу Хантингтона, виявляється в різних структурах мозку та інших тканинах. Хантингтин зазвичай знаходиться переважно в цитоплазмі нейронів. Білок міститься в більшості нейронів мозку, але останні дані показують, що його вміст вищий у матриксних нейронах, ніж у стріосомних нейронах, і вищий у проекційних нейронах, ніж в інтернейронах. Таким чином, селективна чутливість нейронів корелює з вмістом у них хантингтину, який зазвичай присутній у певних нейрональних популяціях.
Як і в мозку пацієнтів з хворобою Хантінгтона, у мишей, трансгенних за N-кінцевим фрагментом гена хвороби Хантінгтона зі збільшеною кількістю повторів, хантінгтин утворює щільні агрегати в ядрах нейронів. Ці внутрішньоядерні включення формуються в нейронах стріаральної проекції (але не в інтернейронах). У трансгенних мишей включення формуються за кілька тижнів до початку симптомів. Ці дані свідчать про те, що білок хантінгтин, що містить збільшену кількість залишків глутаміну, включення яких кодують тринуклеотидні повтори, або його фрагмент, накопичується в ядрі і, як наслідок, може порушити його контроль клітинних функцій.
Симптоми хвороби Хантінгтона
Вік, у якому з'явилися перші симптоми у пацієнтів із хворобою Хантінгтона, важко точно визначити, оскільки захворювання проявляється поступово. Зміни особистості та поведінки, легкі порушення координації можуть виникати за багато років до появи більш очевидних симптомів. На момент встановлення діагнозу у більшості пацієнтів спостерігаються хореїчні рухи, порушення координації дрібних рухів, уповільнена генерація довільних саккад. У міру прогресування захворювання порушується здатність організовувати свою діяльність, знижується пам'ять, утруднюється мовлення, посилюються окорухові розлади та порушення виконання координованих рухів. Хоча на ранній стадії захворювання змін у м'язах та поставі немає, у міру його прогресування можуть розвиватися дистонічні пози, які з часом можуть перетворитися на домінантний симптом. На пізній стадії мовлення стає невиразним, ковтання значно ускладнюється, ходьба стає неможливою. Хвороба Хантінгтона зазвичай прогресує протягом 15-20 років. У термінальній стадії пацієнт безпорадний і потребує постійного догляду. Летальний результат безпосередньо пов'язаний не з основним захворюванням, а з його ускладненнями, наприклад, пневмонією.
Деменція при хворобі Хантінгтона
Код МКХ-10
P02.2. Деменція при хворобі Хантінгтона (G10).
Деменція розвивається як один із проявів системного дегенеративно-атрофічного процесу з переважним ураженням стріарної системи мозку та інших субкокальних ядер. Успадковується за аутосомно-домінантним типом.
Як правило, захворювання проявляється на третьому-четвертому десятилітті життя хореоформним гіперкінезом (особливо в обличчі, руках, плечах, ході), змінами особистості (збудливі, істеричні та шизоїдні типи аномалій особистості), психотичними розладами (особлива депресія з похмурістю, похмурістю, дисфорією; параноїдний настрій).
Особливе значення для діагностики має поєднання хореоформного гіперкінезу, деменції та спадкового обтяження. Для цієї деменції характерні наступні ознаки:
- повільне прогресування (в середньому 10-15 років): дисоціація між залишковою здатністю піклуватися про себе та очевидною інтелектуальною некомпетентністю в ситуаціях, що вимагають продуктивної розумової праці (концептуальне мислення, вивчення нового);
- виражена нерівномірність розумової діяльності, яка базується на грубих порушеннях уваги та непостійності установок пацієнта («уривчасте» мислення, подібне до гіперкінезу);
- атиповість явних порушень вищих кіркових функцій;
- зворотна залежність між зростанням деменції та тяжкістю психотичних розладів.
Враховуючи високу частку психотичних (параноїдний марення ревнощів, переслідування) та дисфоричних розладів у клінічній картині захворювання, лікування проводиться за допомогою різних нейролептиків, що блокують дофамінергічні рецептори (похідні фенотіазину та бутирофенону) або знижують рівень дофаміну в тканинах (резерпін).
Застосовують галоперидол (2-20 мг/добу), тіаприд (100-600 мг/добу) не більше трьох місяців, тіоридазин (до 100 мг/добу), резерпін (0,25-2 мг/добу), протисудомний препарат клоназепам (1,5-6 мг/добу). Ці препарати сприяють зменшенню гіперкінезів, згладженню афективної напруги та компенсації розладів особистості.
Стаціонарне лікування психічних розладів проводиться з урахуванням провідного синдрому, віку та загального стану пацієнта. При амбулаторному лікуванні принципи терапії ті ж (безперервна підтримуюча терапія рухових розладів, періодична зміна препарату). При амбулаторному лікуванні застосовуються нижчі дози нейролептиків.
Реабілітаційні заходи при легкій та помірній деменції включають трудотерапію, психотерапію та когнітивний тренінг. Необхідна робота з членами сім'ї та надання психологічної підтримки людям, які доглядають за пацієнтом. Основним методом профілактики захворювання є медико-генетичне консультування найближчих родичів пацієнта з направленням на аналіз ДНК при вирішенні питання про дітонародження.
Прогноз, як правило, несприятливий. Перебіг захворювання повільно прогресуючий, і зазвичай хвороба призводить до смерті через 10-15 років.
 [ 18 ]
[ 18 ]
Що турбує?
Діагностика хвороби Хантінгтона
Діагноз ставиться на основі типових симптомів, сімейного анамнезу та генетичного тестування. Через атрофію головки хвостатого ядра, МРТ та КГ виявляють збільшення шлуночків головного мозку на пізній стадії захворювання.
Лікування хвороби Хантінгтона
Лікування хвороби Хантінгтона симптоматичне. Хорею та збудження можна частково придушити нейролептиками (наприклад, хлорпромазин 25-300 мг перорально 3 рази на день, галоперидол 5-45 мг перорально 2 рази на день) або резерпін 0,1 мг перорально один раз на день. Дози збільшують до максимально переносимих (до появи побічних ефектів, таких як сонливість, паркінсонізм; для резерпіну - гіпотензія). Метою емпіричної терапії є зменшення глутаматергічної передачі через N-метил-O-аспартатні рецептори та підтримка вироблення енергії в мітохондріях. Лікування, спрямоване на збільшення рівня ГАМК у мозку, неефективне.
Генетичне тестування та консультування важливі, оскільки симптоми захворювання з'являються після дітородного віку. Людей з позитивним сімейним анамнезом та тих, хто зацікавлений у тестуванні, направляють до спеціалізованих центрів з урахуванням усіх етичних та психологічних наслідків.
Симптоматичне лікування хвороби Хантінгтона
Не існує ефективного лікування, яке може зупинити прогресування хвороби Хантінгтона. Було проведено кілька випробувань різних препаратів, але значного ефекту досягнуто не було. Нейролептики та інші антагоністи дофамінових рецепторів широко використовуються для корекції психічних розладів та мимовільних рухів у пацієнтів з хворобою Хантінгтона. Мимовільні рухи відображають дисбаланс між дофамінергічною та ГАМКергічною системами. Відповідно, нейролептики використовуються для зменшення надмірної дофамінергічної активності. Однак самі ці препарати можуть викликати значні когнітивні та екстрапірамідні побічні ефекти. Крім того, за винятком випадків, коли у пацієнта розвивається психоз або збудження, їх ефективність не доведена. Нейролептики часто викликають або посилюють дисфагію чи інші рухові розлади. Нейролептики нового покоління, такі як рисперидон, клозапін та оланзапін, можуть бути особливо корисними при лікуванні хвороби Хантінгтона, оскільки вони викликають менше екстрапірамідних побічних ефектів, але можуть зменшити параноїдні симптоми або підвищену дратівливість.
Тетрабеназин та резерпін також знижують активність дофамінергічної системи та можуть зменшити тяжкість мимовільних рухів на ранніх стадіях захворювання. Однак ці препарати можуть викликати депресію. Оскільки саме захворювання часто викликає депресію, цей побічний ефект значно обмежує застосування резерпіну та тетрабеназину. На пізніх стадіях захворювання клітини, що несуть дофамінові рецептори, гинуть, тому ефективність антагоністів дофамінових рецепторів послаблюється або втрачається.
Нейролептики, антидепресанти та анксіолітики використовуються для лікування психозу, депресії та дратівливості у пацієнтів із хворобою Хантінгтона, але їх слід призначати лише доти, доки у пацієнта дійсно є ці симптоми. Препарати, які можуть бути корисними на одній стадії захворювання, можуть стати неефективними або навіть шкідливими в міру прогресування хвороби.
Агоністи рецепторів ГАМК були випробувані у пацієнтів із хворобою Хантінгтона, оскільки було показано, що при хворобі Хантінгтона спостерігається значне зниження рівня ГАМК у стріатумі, а також гіперчутливість рецепторів ГАМК у його проекційних зонах. Бензодіазепіни довели свою ефективність у випадках, коли мимовільні рухи та когнітивні порушення посилюються стресом і тривогою. Слід призначати низькі дози цих препаратів, щоб уникнути небажаних седативних ефектів. У більшості пацієнтів із хворобою Хантінгтона жоден із препаратів не призводить до значного покращення якості життя.
При хворобі Хантінгтона з раннім початком та паркінсонічними симптомами можна спробувати дофамінергічні препарати, але їхня ефективність обмежена. Крім того, леводопа може спричинити або посилити міоклонус у цих пацієнтів. Водночас баклофен може зменшити ригідність у деяких пацієнтів із хворобою Хантінгтона.
 [ 26 ], [ 27 ], [ 28 ], [ 29 ]
[ 26 ], [ 27 ], [ 28 ], [ 29 ]
Профілактичне (нейропротекторне) лікування хвороби Хантінгтона
Хоча генетичний дефект при хворобі Хантінгтона відомий, як він призводить до селективної нейрональної дегенерації залишається незрозумілим. Існує гіпотеза, що превентивна терапія, спрямована на зниження оксидативного стресу та ексайтотоксичності, може потенційно уповільнити або зупинити прогресування захворювання. Ситуація може бути дещо схожою на гепатолентикулярну дегенерацію, при якій генетичний дефект залишався невідомим протягом багатьох років, але превентивна терапія, спрямована на вторинний ефект – накопичення міді, була «вилікувана». У зв'язку з цим особливу увагу привернула гіпотеза про те, що хвороба Хантінгтона пов'язана з порушенням енергетичного обміну та загибеллю клітин через ексайтотоксичність. Сама хвороба може спричиняти загибель клітин через внутрішньоядерну агрегацію N-кінцевих фрагментів хантінгтону, що порушує клітинні та метаболічні функції. Цей процес може впливати на деякі групи нейронів більшою мірою, ніж на інші, через їхню вищу чутливість до ексайтотоксичного пошкодження. У цьому випадку превентивна терапія антагоністами рецепторів збуджуючих амінокислот або агентами, що запобігають пошкодженню вільними радикалами, зможе запобігти або відтермінувати початок і прогресування захворювання. У лабораторних моделях аміотрофічного бічного склерозу було показано, що антиоксидантні агенти та антагоністи рецепторів (РАА) здатні уповільнювати прогресування захворювання. Подібні підходи можуть бути ефективними при хворобі Хантінгтона. Наразі тривають клінічні випробування антагоністів глутаматних рецепторів та агентів, що посилюють функцію комплексу II мітохондріального ланцюга електронного транспорту.
 [ 30 ], [ 31 ], [ 32 ], [ 33 ], [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ]
[ 30 ], [ 31 ], [ 32 ], [ 33 ], [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ]

