
Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Чому виживання фоторецепторних клітин не досягає 100%: з'ясовані ключові механізми
Останній перегляд: 09.08.2025
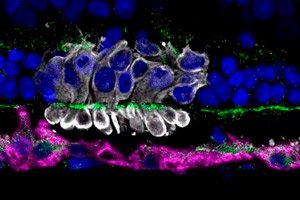
Вчені з Пенсильванського університету під керівництвом Раґхаві Судхарсана з'ясували, чому близько 70% трансплантованих фотосенсорних клітин-попередників (PRPC) з індукованих плюрипотентних стовбурових клітин гинуть протягом перших кількох днів після трансплантації в сітківку. Їхня робота, опублікована в Stem Cell Research & Therapy, вказує на метаболічний стрес у донорських клітинах як на головну причину ранньої втрати.
Передумови
Трансплантація клітин первинної імуноглобуліну (PRPC) вважається перспективним підходом до лікування прогресуючих дегенеративних захворювань сітківки (пігментного ретиніту, макулярної дегенерації). Однак низький рівень виживання донорських клітин обмежує ефективність терапії. Досі основна увага приділялася пригніченню імунної відповіді, але навіть при екстенсивній імуносупресії втрати залишалися катастрофічними.
Дизайн та методи
Моделі:
Здоровим собакам та собакам-моделям з пігментним ретинітом було проведено субретинальні ін'єкції флуоресцентно мічених PRPC.
Оцінка виживання:
Флуоресцеїнова ангіографія та оптична когерентна томографія (ОКТ) реєстрували об'єм трансплантованих клітин на перший, 3-й та 7-й день.
Транскриптоміка окремих клітин (scRNA-seq):
PRPC були виділені з ділянок сітківки на 3-й день, та проаналізована експресія генів, пов'язаних з метаболізмом та апоптозом.
Імуногістохімія:
У зоні трансплантації оцінювали маркери оксидативного стресу (4-HNE), мітохондріальний статус (Tom20) та активацію мікроглії (Iba1).
Ключові результати
- Масова втрата клітин: приблизно 70% клітин первинного клітинного росту (PRPC) зникали до 7-го дня як у здорових, так і в дегенеруючих сітківках, незважаючи на імуносупресію.
- Метаболічний стрес: scRNA-seq виявило різке зниження експресії генів окисного фосфорилювання (CYCS, COX4I1) та збільшення транскрипції апоптотичних маркерів (BAX, CASP3).
- Мітохондріальна дисфункція: Імуногістохімія показала фрагментацію та втрату мічення Tom20 у трансплантованих PRPC, а підвищений рівень 4-HNE вказував на оксидативне пошкодження.
- Роль мікроглії: В області трансплантації активність мікрогліальних клітин Iba1⁺ збільшувалася у відповідь на загибель PRPC, що може посилити місцеве запалення та сприяти подальшим втратам.
Наслідки для клітинної терапії
Ці висновки змінюють парадигму: для збільшення приживлення PRPC необхідно не лише пригнічувати імунну відповідь, але й підтримувати енергетичний метаболізм донорських клітин. Можливі втручання:
- Попереднє «метаболічне попереднє тренування» PRPC за нормальних умов культивування на межі субстресового навантаження для підвищення їхньої мітохондріальної стійкості.
- Коктейлі мітохондріальних стабілізаторів (коензим Q₁₀, карнітин) під час та одразу після трансплантації.
- Модуляція локального мікросередовища сітківки: доставка антиоксидантів або мітохондріальних протекторів до області трансплантації.
Практичні висновки та перспективи
- Метаболічне прекондиціонування: кондиціонування клітин первинного трансплантованого клітинного трансплантату (PRPC) в умовах легкого метаболічного стресу перед трансплантацією для підвищення їхньої стійкості.
- Доставка каркасом: використання біорозкладних матриць, що забезпечують поступовий перехід донорських клітин з багатого культурального середовища в середовище сітківки.
- Харчова підтримка: доставка антиоксидантів або субстратів мітохондріального дихання разом з PRPC.
«Ми довго боролися лише з імунним бар'єром, але тепер зрозуміло, що без вирішення проблеми метаболічного шоку трансплантати приречені на передчасну смерть», – підсумовує Рагхаві Судхарсан.
Робота, що підтримується Національним інститутом ока, прокладає шлях для більш життєздатних клітинних терапій для відновлення зору у пацієнтів з дегенеративними захворюваннями сітківки.
