
Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
«Кисень для клітин»: простий імплантат допоміг знизити рівень цукру без сильнодіючих ліків
Останній перегляд: 18.08.2025
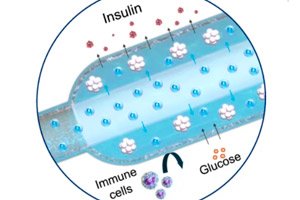 ">
">У журналі Nature Communications було описано новий «кисневий» імплантат для лікування діабету 1 типу: компактний електрохімічний генератор кисню (iEOG) безперервно постачає O₂ до макрокапсули з клітинами, що секретують інсулін. Ця система дозволяє щільно упаковувати ізольовані острівці (до 60 000 IEQ/мл) та підтримувати їх життєздатність та секрецію навіть в умовах низького вмісту кисню. У щурів з діабетом пристрій, імплантований під шкіру, підтримував нормальний рівень цукру до трьох місяців — без імуносупресії. Контрольні щури без кисню залишалися гіперглікемічними.
Передісторія
- Головна технічна проблема — кисень. Щойно ми «ховаємо» клітини за мембраною та підводимо пристрій під шкіру (зручно та легко витягуємо), їм не вистачає кисню: дифузія через мембрану та погано кровоносне місце не задовольняє потреби «ненажерливих» острівців. Звідси рання загибель, слабка робота та необхідність сильно проріджувати посів — інакше капсула виходить величезною.
- Чому це так фізично складно? Кисень проходить через тканини лише на дуже короткі відстані, а інкапсульовані клітини не мають власних судин – перші місяці вони живуть лише завдяки пасивній дифузії. Будь-яке потовщення матеріалів або «ущільнення» клітин швидко переводить центр капсули в гіпоксію.
- Що ви пробували раніше?
- Вони створили макропристрої, що поповнюються киснем (наприклад, βAir): всередині є резервуар, який щодня поповнюється киснем; були проведені доклінічні та ранні клінічні випробування. Це працює, але трудомістко для пацієнта.
- Були випробувані хімічні донори O₂ та матеріали-"носії" (перфторсполуки): вони допомагають, але дають короткочасний та важкоконтрольований ефект. Також з'явилися "повітряні" рамки для прискорення доставки O₂ у товщу гелю.
- Самі капсули та місця імплантації (тонкі мембрани, преваскуляризація) були покращені, але без зовнішнього джерела O₂ вони все ще стикаються з обмеженнями щільності клітин.
- Яку прогалину в головоломці заповнює нова робота? Автори Nature Communications демонструють безперервне постачання кисню з міні-генератора прямо всередині системи макроінкапсуляції: пристрій бере воду з тканин та електрохімічно вивільняє O₂, який рівномірно «дихає» вздовж капсули з клітинами. Ідея полягає в тому, щоб дати капсулі «власний акваріумний компресор», щоб вона могла упакувати більше клітин і при цьому підтримувати їх живими та працездатними – навіть у підшкірному, не дуже «насиченому киснем» місці.
Чому це взагалі потрібно?
Трансплантація острівців або бета-клітин є одним із найперспективніших шляхів до «функціонального лікування» діабету 1 типу. Але існують дві основні перешкоди:
- Імунітет – зазвичай вимагає довічного прийому імунодепресантів;
- Кисневе голодування – капсули, що захищають імунну систему, одночасно відрізають клітини від судин, а бета-клітини, ненажерливі до O₂, швидко «задихаються». Нова робота вражає другу перешкоду: вона надає капсулі власне, контрольоване джерело кисню.
Як працює імплантат
- Дві частини. У титановому корпусі розташований міні-генератор кисню (iEOG), який видобуває воду з міжклітинної рідини та вивільняє O₂ шляхом електролізу; поруч із ним розташована тонка лінійна капсула з клітинами (схожа на довгу «ковбаску»), через яку проходить газопроникна трубка: кисень рівномірно поглинається вздовж усієї капсули. Між клітинами та тканинами є напівпроникна мембрана (електроспін + альгінат): глюкоза та інсулін проходять, імунні клітини – ні.
- Розміри: Друга версія iEOG має діаметр 13 мм і товщину 3,1 мм, важить близько 2 г. У поєднанні з капсулою таку систему можна вводити та видаляти через невеликий розріз, що важливо для безпеки.
- Продуктивність. Генератор виробляє ~1,9–2,3 см³ O₂/год і підтримує заданий потік протягом місяців і навіть років (у тривалих випробуваннях у фізіологічному розчині — до 2,5 років), а після імплантації щурам цей рівень підтримувався. Такий потік розрахований на покриття потреб сотень тисяч еквівалентів острівців — порядку величини, необхідного людині.
Що показали експерименти
- In vitro: При 1% O₂ (важка гіпоксія) оксигенація підтримувала життєздатність та секрецію в агрегатах INS-1 та в людських острівцях, упакованих у дуже щільний шар (60 000 IEQ/мл).
- In vivo (щури). Після підшкірної імплантації в алогенній моделі діабету система iEOG нормалізувала глікемію на термін до 3 місяців без імуносупресії; пристрої без кисню не мали жодного ефекту. Гістологія навколо генератора не виявила суттєвих побічних реакцій.
Чому це важливо для клініки?
- Крок до «реалістичних розмірів». Щоб забезпечити дорослу людину дозою 300–770 тис. IEQ, капсула має бути щільно упакована – це завжди було обмежено киснем. Контрольована подача O₂ «знімає стелю» щільності та дає шанс зробити пристрій достатньо компактним для реальної імплантації.
- Плюс зручність. Раніше ми пробували хімічні донори кисню (пероксиди) – вони діють недовго та неконтрольовані, а також резервуари O₂ з щоденним «підживленням» через шкіру – громіздкі та незручні. Тут кисень подається постійно та дозовано, без ін’єкцій.
Технічні деталі, що вражають
- Джерелом води є тканина. iEOG всмоктує пару інтерстиціальної рідини через пористе «вікно», а потім за допомогою класичного мембранно-електродного вузла (MEA) та напруги 1,4–1,8 В вода розділяється на H₂ та O₂; гази видаляються через різні канали.
- Довговічність. Три пристрої у фізіологічному розчині працювали протягом 11 місяців, 2 років та 2,5 років на постійному струмі без деградації під дією кисню; після імплантації імунодефіцитним та імунокомпетентним щурам працездатність зберігалася.
Обмеження та «що далі»
Це ще доклінічний етап: щури, висока щільність у капсулі, постачання кисню – все чудово, але ключові випробування попереду:
- масштабування до доз та часових рамок для людини;
- надійність та живлення електрохіміків в організмі людини протягом багатьох років (архітектура джерела живлення в статті не детально описана);
- мінімізація фіброзу навколо капсул та дифузійна стабільність;
- тестування на бета-стовбурових клітинах та на моделях, ближчих до людських. Автори відкрито порівнюють своє рішення з попередніми підходами та позиціонують його як платформу для клінічно перекладних капсул.
Висновок
Щоб пересаджені бета-клітини могли жити та функціонувати без імуносупресантів, їм потрібно дихати. Команда Корнелла та партнерів показала, що міні-генератор кисню, вбудований у лінійну капсулу, може «годувати» клітини O₂ достатньо довго та рівномірно, щоб вони витримували високу щільність та знижували рівень цукру навіть у підшкірному місці. Клініка ще далеко, але інженерна логіка проста та красива — давати клітинам повітря там, де його не вистачає.
