
Весь контент iLive перевіряється медичними експертами, щоб забезпечити максимально можливу точність і відповідність фактам.
У нас є строгі правила щодо вибору джерел інформації та ми посилаємося тільки на авторитетні сайти, академічні дослідницькі інститути і, по можливості, доведені медичні дослідження. Зверніть увагу, що цифри в дужках ([1], [2] і т. д.) є інтерактивними посиланнями на такі дослідження.
Якщо ви вважаєте, що який-небудь з наших матеріалів є неточним, застарілим або іншим чином сумнівним, виберіть його і натисніть Ctrl + Enter.
Замкнута система доставки ліків може поліпшити хіміотерапію
Останній перегляд: 02.07.2025
 ">
">Коли онкохворі проходять хіміотерапію, дози більшості препаратів розраховуються на основі площі поверхні тіла пацієнта. Вона оцінюється за допомогою рівняння, яке враховує зріст і вагу пацієнта. Це рівняння було сформульовано в 1916 році на основі даних лише дев'яти пацієнтів.
Такий спрощений підхід до дозування не враховує інші фактори та може призвести до того, що пацієнту буде призначено занадто багато або занадто мало препарату. В результаті деякі пацієнти можуть відчувати непотрібну токсичність або недостатню ефективність хіміотерапії, яку вони отримують.
Щоб підвищити точність дозування хіміотерапії, інженери Массачусетського технологічного інституту розробили альтернативний підхід, який дозволяє персоналізувати дозу для кожного пацієнта. Їхня система вимірює кількість препарату в організмі пацієнта та передає ці дані в контролер, який може відповідно регулювати швидкість інфузії.
Цей підхід може допомогти компенсувати відмінності у фармакокінетиці препаратів, спричинені складом тіла, генетичною схильністю, токсичністю органів, викликаною хіміотерапією, взаємодією з іншими препаратами та їжею, а також циркадними варіаціями ферментів, відповідальних за розщеплення хіміотерапевтичних препаратів, кажуть дослідники.
«Визнаючи досягнення в розумінні метаболізму ліків та застосовуючи інженерні інструменти для спрощення персоналізованого дозування, ми вважаємо, що можемо допомогти трансформувати безпеку та ефективність багатьох препаратів», — сказав Джованні Траверсо, доцент кафедри машинобудування в Массачусетському технологічному інституті, гастроентеролог у лікарні Brigham and Women's Hospital та старший автор дослідження.
Луїс ДеРіддер, аспірант Массачусетського технологічного інституту, є провідним автором статті, опублікованої в журналі Med.
Безперервний моніторинг
У цьому дослідженні вчені зосередилися на препараті під назвою 5-фторурацил, який використовується для лікування колоректального раку та інших видів раку. Препарат зазвичай вводять протягом 46 годин, а його дозування визначається за формулою, що ґрунтується на зрості та вазі пацієнта, що дає оцінку площі поверхні тіла.
Однак цей підхід не враховує відмінності у складі тіла, які можуть впливати на розподіл препарату в організмі, або генетичні варіації, які впливають на його метаболізм. Ці відмінності можуть призвести до шкідливих побічних ефектів, якщо ввести занадто багато препарату. Якщо ввести недостатньо препарату, він може не знищити пухлину, як очікувалося.
«Люди з однаковою площею поверхні тіла можуть мати дуже різний зріст і вагу, різну м’язову масу або різну генетику, але якщо зріст і вага, підставлені до цього рівняння, дають однакову площу поверхні тіла, їхня доза ідентична», — каже ДеРіддер, кандидат наук у програмі медичної інженерії та медичної фізики в програмі Гарвард-MIT з медичних наук і технологій.
Ще одним фактором, який може змінювати кількість препарату в крові в будь-який момент часу, є циркадні коливання ферменту, який називається дигідропіримідиндегідрогеназа (DPD), що розщеплює 5-фторурацил. Експресія DPD, як і багатьох інших ферментів в організмі, регулюється циркадним ритмом. Таким чином, деградація 5-FU за допомогою DPD не є постійною, а змінюється залежно від часу доби. Ці циркадні ритми можуть призвести до десятикратної коливання кількості 5-FU в крові пацієнта під час інфузії.
«Використовуючи площу поверхні тіла для розрахунку дози хіміотерапії, ми знаємо, що дві людини можуть мати дуже різну токсичність 5-фторурацилу. Один пацієнт може мати цикли лікування з мінімальною токсичністю, а потім цикл з жахливою токсичністю. Щось змінилося в тому, як пацієнт метаболізував хіміотерапію від одного циклу до наступного. Наш застарілий метод дозування не враховує ці зміни, і пацієнти страждають в результаті», — каже Дуглас Рубінсон, клінічний онколог Інституту раку Дана-Фарбер та автор статті.
Один зі способів спробувати компенсувати мінливість фармакокінетики хіміотерапії – це стратегія, яка називається терапевтичним моніторингом препарату, за якої пацієнт здає зразок крові в кінці одного циклу лікування. Після аналізу цього зразка на концентрацію препарату дозування можна скоригувати, якщо необхідно, на початку наступного циклу (зазвичай через два тижні для 5-фторурацилу).
Було показано, що цей підхід призводить до кращих результатів для пацієнтів, але він не отримав широкого застосування для хіміотерапії, такої як 5-фторурацил.
Дослідники Массачусетського технологічного інституту хотіли розробити подібний тип моніторингу, але в автоматизованому режимі, який би дозволив персоналізувати дозування ліків у режимі реального часу, що могло б призвести до кращих результатів для пацієнтів.
У їхній системі із замкнутим циклом концентрації препаратів можна безперервно контролювати, і ця інформація використовується для автоматичного регулювання швидкості інфузії хіміотерапевтичного препарату для підтримки дози в межах цільового діапазону.
Ця замкнена система дозволяє персоналізувати дозування ліків з урахуванням циркадних ритмів рівнів ферментів, що метаболізують ліки, а також будь-яких змін у фармакокінетиці пацієнта з моменту останнього лікування, таких як органна токсичність, викликана хіміотерапією.
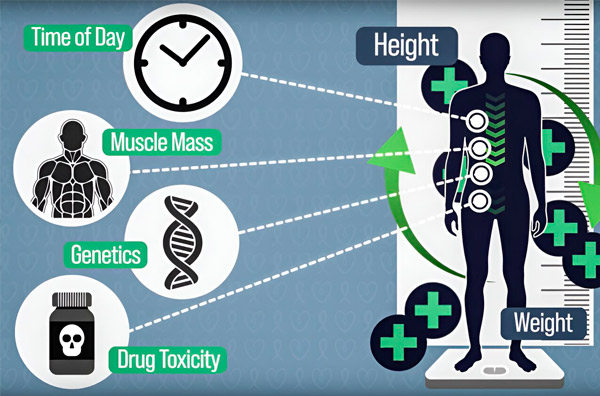
Щоб зробити дозування хіміотерапії точнішим, інженери Массачусетського технологічного інституту розробили спосіб безперервного вимірювання кількості препарату в організмі пацієнта протягом багатогодинної інфузії. Це допоможе компенсувати відмінності, спричинені складом тіла, генетикою, токсичністю препаратів та циркадними коливаннями. Джерело: Надано дослідниками.
Нова система, розроблена дослідниками, відома як CLAUDIA (Closed-Loop AUtomated Drug Infusion regulator - автоматичний регулятор інфузії лікарських засобів із замкнутим циклом), використовує комерційно доступне обладнання для кожного кроку. Зразки крові беруться кожні п'ять хвилин і швидко готуються до аналізу. Вимірюється концентрація 5-фторурацилу в крові та порівнюється з цільовим діапазоном.
Різниця між цільовою та виміряною концентраціями вводиться в алгоритм керування, який потім коригує швидкість інфузії за потреби, щоб підтримувати дозу в діапазоні концентрацій, за яких препарат є ефективним та нетоксичним.
«Ми розробили систему, за допомогою якої ми можемо безперервно вимірювати концентрацію препарату та відповідно коригувати швидкість інфузії, щоб підтримувати концентрацію препарату в терапевтичному вікні», — каже ДеРіддер.
Швидке налаштування
У дослідженнях на тваринах дослідники виявили, що за допомогою препарату CLAUDIA вони можуть підтримувати кількість препарату, що циркулює в організмі, в цільовому діапазоні приблизно 45 відсотків часу.
Рівні препаратів у тварин, які отримували хіміотерапію без препарату CLAUDIA, залишалися в цільовому діапазоні в середньому лише у 13 відсотках випадків. Дослідники не перевіряли ефективність рівнів препаратів у цьому дослідженні, але вважається, що підтримка концентрацій у цільовому діапазоні призводить до кращих результатів та меншої токсичності.
CLAUDIA також змогла підтримувати дозу 5-фторурацилу в цільовому діапазоні навіть при введенні препарату, що інгібує фермент DPD. У тварин, яким давали цей інгібітор без постійного моніторингу та корекції, рівень 5-фторурацилу збільшився до восьми разів.
Для цієї демонстрації дослідники вручну виконували кожен крок процесу, використовуючи стандартне обладнання, але тепер планують автоматизувати кожен крок, щоб моніторинг та коригування дози можна було проводити без втручання людини.
Для вимірювання концентрацій препаратів дослідники використовували високоефективну рідинну хроматографію-мас-спектрометрію (ВЕРХ-МС) – метод, який можна адаптувати для виявлення практично будь-якого типу препарату.
«Ми бачимо майбутнє, де ми зможемо використовувати CLAUDIA для будь-якого препарату, який має відповідні фармакокінетичні властивості та виявляється за допомогою ВЕРХ-МС, що дозволить персоналізоване дозування для багатьох різних препаратів», — каже ДеРіддер.
